基于商业化常规LNP递送系统和自主知识产权的LNP递送系统,依诺生物分别形成了相应体系的液体制剂技术,并结合混合后包封技术实现了多mRNA序列、mRNA/sgRNA混合或mRNA/siRNA混合的共包封液体制剂高质量生产,满足客户针对季节性或新发疾病防治以及个性化治疗等应用场景的mRNA产品制剂开发和临床试验基本需求。在此基础上,依诺生物针对mRNA液体制剂热稳定性差的缺陷,在全球率先发展了mRNA冻干制剂技术,实现了各种LNP递送和非LNP递送mRNA制剂的热稳定性提升,并成功应用于多mRNA序列、mRNA/sgRNA混合或mRNA/siRNA混合等共包封冻干制剂的高质量生产,更好满足客户适应于更普遍应用场景的mRNA产品开发和商业化需求。

mRNA液体制剂稳定性差是mRNA药物开发中面临的主要挑战,很大程度上限制了mRNA产品的推广以及质量水平。Moderna的mRNA-1345疫苗需在-20℃保存,18个月时mRNA完整性降低至50%;辉瑞的BNT162b2疫苗需在-80℃至-60℃保存,化冻后室温仅能稳定2小时。苛刻的保存条件和低稳定性限制了核酸药物的临床可及性。mRNA存在多个水解酶解位点,它在水溶液中天然的稳定性就比较差;LNP为电中性纳米颗粒,在运输过程中易发生破裂、融合;LNP中的脂质,尤其是可离子化脂质,通常为可降解的结构,以提高体内代谢速度、降低毒性,但脂质的不稳定也进一步造成了整个mRNA药物的不稳定。
以上种种原因造成了mRNA药物不稳定,为了提高mRNA药物稳定性,可采用AI算法对mRNA序列进行优化,筛选出热力学更稳定的mRNA序列;或改进LNP配方,引入一定比例的PEG脂质提高LNP的物理稳定性;还可以添加合适的冷冻保护剂和缓冲盐,减缓mRNA和脂质的氧化水解。以上种种优化对mRNA制剂稳定性都有一定提升效果,但仍不能满足一些对稳定性要求较高的场景。
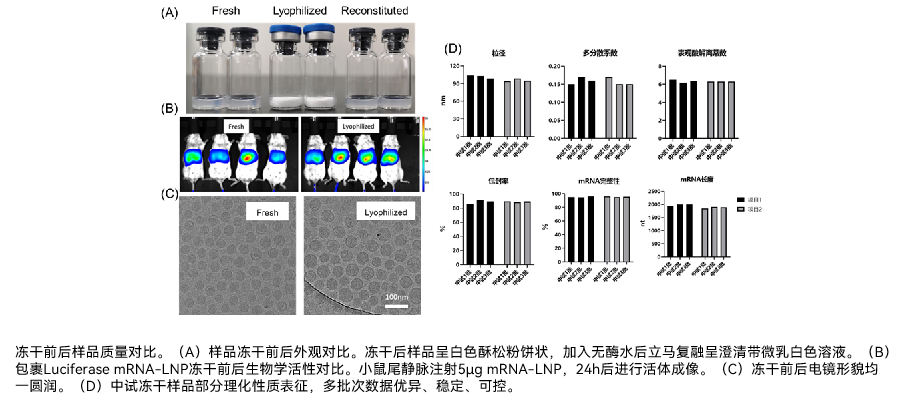
为了进一步克服mRNA制剂不稳定的问题,依诺生物发展了mRNA冻干制剂技术。通过冷冻干燥尽可能保持样品的结构完整性的同时温和地除去游离水和氧气阻止脂质氧化水解并通过固化减少纳米颗粒热运动提高稳定性。然而,脂质纳米颗粒成分复杂,对冷冻和干燥工艺敏感,特别是对于核酸大分子来说,冷冻干燥过程产生的应力极容易破坏其结构,现有的常规冻干工艺无法维持mRNA-LNP的稳定性和生物活性。
依诺生物采用DOE工艺设计,研究不同冻干保护剂、保护剂使用量、冻干曲线等对于冻干制剂的影响;在此基础上建立mRNA-LNP及mRNA冻干制剂平台,成功实现了基于商业化通用LNP递送系统和自主知识产权的LNP递送系统以及自主知识产权的非LNP递送系统等多种mRNA制剂和mRNA-LNP制剂的冻干。冻干制剂极易复溶,冻干前后理化性质和生物活性保持一致,并且大幅提升了制剂的热稳定性(可于常规冷链2-8℃或常温储运),提高mRNA疫苗和药物的可及性。
目前冻干工艺在依诺生物及相关合作方的多个管线中已有应用,并顺利完成若干管线的临床注册申报和I期临床或IIT实验,其有效性和安全性都已在不同产品中得到广泛验证。